�������Љ� �m�e����Љ�F���n
����ᇊw����
�X�^�b�t�F�g�苳���A�e��u�t�A�ߓ������A���������A��������
���������̓]�ڑ��i�@�\�Ɋւ��錤��
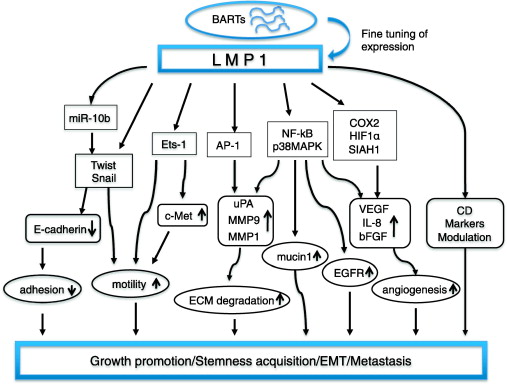
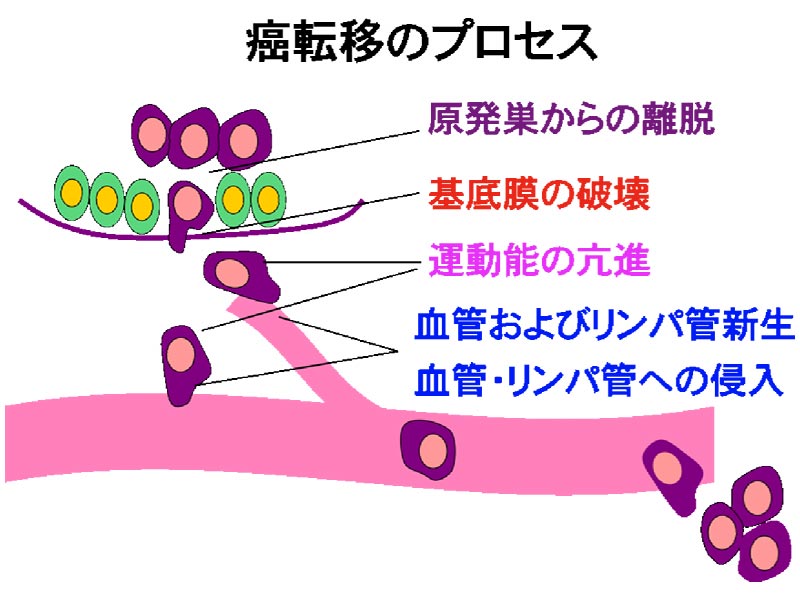 �@���������̔������Epstein-Barr�E�C���X�iEBV�j�Ƃ̊֘A�ɂ��Ă͍���^���]�n�͂���܂��A�������ł͓���EBV�֘A���݊�����`�q�ł���latent membrane protein 1�iLMP1�j�ɒ��ڂ��ALMP1�ɂ���ᇍזE�̐Z���E�]�ڑ��i��p�ɂ��Čp���I�Ɍ������Ă��܂����B
�@���������̔������Epstein-Barr�E�C���X�iEBV�j�Ƃ̊֘A�ɂ��Ă͍���^���]�n�͂���܂��A�������ł͓���EBV�֘A���݊�����`�q�ł���latent membrane protein 1�iLMP1�j�ɒ��ڂ��ALMP1�ɂ���ᇍזE�̐Z���E�]�ڑ��i��p�ɂ��Čp���I�Ɍ������Ă��܂����B
�@���̌��ʁALMP1��matrix metalloproteinase 9, matrix metalloproteinase 1, vascular endothelial growth factor, interleukin 8, fibroblast growth factor 2�Ȃǎ�ᇂ̐Z����]�ڂɏd�v�ȗl�X�Ȉ��q��U�����鎖���ؖ����܂����B
�@�ȏ�����ƂɌ��݈ȉ��̃v���W�F�N�g���s�Ӑ��s���ł��B
�@�ȏ�����ƂɌ��݈ȉ��̃v���W�F�N�g���s�Ӑ��s���ł��B
 |
||
1. ��������u�����זE�v���Ɓu�זE�����v
�@ �ߔN���ڂ���Ă���u�����זE�v�ɏœ_��u���C��������ɂ�����u�����זE�v�ɂ��Č������s���Ă���܂��B�u�����זE�v�Ƃ́A���זE�̒��ɏ����̊��זE�l�̊��זE�����݂�����炪�������J��Ԃ����ƂŊ������B����Ƃ������_�ł��B�������́ALMP1�𐳏������זE�ɓ������邱�ƂŁC�u�����זE�v�����U������邱�Ƃ����܂����B���̃��f�����g�p���邱�Ƃɂ���āA�P�ɃE�B���X���`���ɂ���Ċ����זE���쐬���邱�Ƃɐ������������łȂ��A�������ʓI�ȁu�����זE�v������͂���c�[���Ƃ��ėL���ł��B���̃��f������ɁA����זE�ɂ��O���a�ς���ъ����זE����Ƃ����V���Ȋ����Â̕��q��Ղ��\�z���邱�Ƃ�ڕW�Ƃ��āC���݁C���̃��f����p���Ċ����זE�Ǝ��͐���זE�̑��ݍ�p�C�u�זE�����v���ۂɂ��Č������ŁA�X�ɏ�������̔����J�j�Y������͂�i�߂Ă��܂��B
2. RAGE�U���ɂ�錌�ǐV�������p�ߓ]�ڑ��i
�@receptor for advanced glycation end products (RAGE)�`���͖Ɖu�O���u�����E�X�[�p�[�t�@�~���[�ɑ�����}���`�E���K���h�E���Z�v�^�[�ŁA�ߔN�A���A�a���邢�͎�ᇂɂ�����a�I���ǐV���ɐ[���֗^���Ă��邱�Ƃ�������܂����B�������ł́ARAGE��LMP1���L�[�Ƃ��錌�ǐV���̗U���ɐ[���֗^���Ă���Ƒz�肵�A���������g�D�W�{�ł͎�ᇍזE�ɂ�����RAGE�`���̔�����LMP1�̔�������ю�ᇓ����ǐV���ƗL�ӂɑ��ւ��邱�ƁA����ɏ�������R���זE�ɂ�����LMP1�̔�����RAGE�̔�����U�����邱�ƁA�������܂����B�ȏォ��RAGE�����������ɂ����Č��ǐV�����i���q���Ȃ킿�����p�ߓ]�ڑ��i���q�ł��邱�Ƃ��������܂����B
3. ���������̖Ɖu����@�\�Ɋւ����b�I����
�@���������͍R�������ア����ꂽEBV�֘A�`���iEBNA1, LMP1, LMP2A�j�����Ă��܂��B���݊����́A�����R���R����epitope��F������זE��Q��T�זE�iCTL�j�ɂ���ăR���g���[������Ă��܂����A���������ł͂�����epitope�ɑΉ�����CTL�̋@�\�����炩�ɗ}������Ă���A���̌��ʏ��������זE��CTL�̊Ď���邱�Ƃ����ɔ������Ă��܂��B
�@�������ł�LMP1���R������ɂ��������̉𖾂̂��߂̊�b�I�����ɂ����g��ł��܂��B���̌��ʁALMP1�̍R����W���Ă���ӔC���ʂ�LMP1�`����N���[�ɂ��鎖���������܂����B���̎����́AN���[�����LMP1���זE���ŋÏW���鎖�ALMP1�ɂ��NF-��B�V�O�i���������ɋÏW���K�{�����ł��鎖�A���狻���[�������ł���܂��B�����LMP1��N���[�ɒ��ڂ��A���������̖Ɖu����@�\�Ɋւ��錤����i�߂Ă����\��ł���܂��B
�@�������ł�LMP1���R������ɂ��������̉𖾂̂��߂̊�b�I�����ɂ����g��ł��܂��B���̌��ʁALMP1�̍R����W���Ă���ӔC���ʂ�LMP1�`����N���[�ɂ��鎖���������܂����B���̎����́AN���[�����LMP1���זE���ŋÏW���鎖�ALMP1�ɂ��NF-��B�V�O�i���������ɋÏW���K�{�����ł��鎖�A���狻���[�������ł���܂��B�����LMP1��N���[�ɒ��ڂ��A���������̖Ɖu����@�\�Ɋւ��錤����i�߂Ă����\��ł���܂��B
4. ��������ƃG�N�\�\�[��
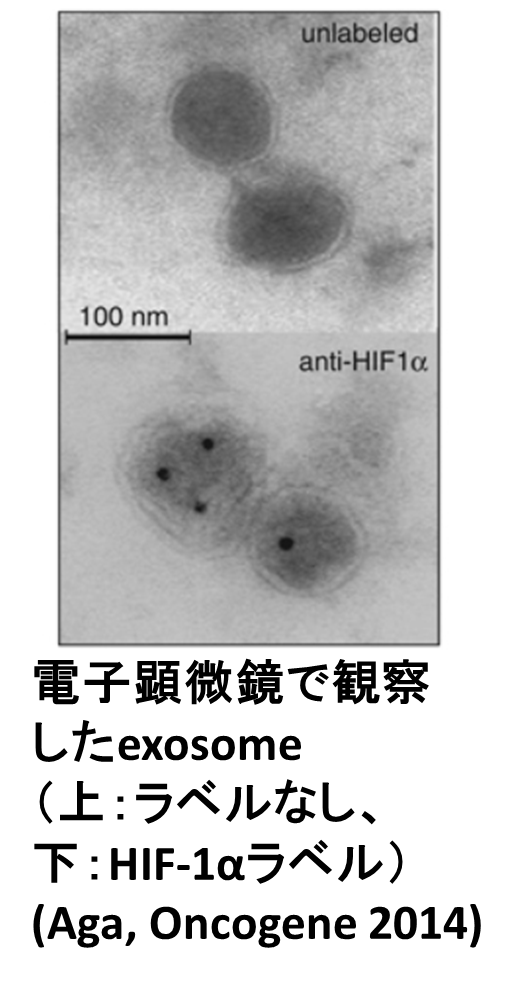 �@��ᇂ���芪���������́A��ᇕa�Ԑ����w�ɂ����ďd�v�Ȗ�����S���Ă���A�����ɂ��Ă̌����͌��ݒ��ڂ��W�߂Ă��܂��B��ᇍזE������o���������E��G�N�\�\�[�����o�R���ԐړI�ȍזE�ԑ��ݍ�p���s���Ă��邱�Ƃ��ߔN�̌����ɂ�薾�炩�ɂȂ��Ă��܂��B�G�N�\�\�[���Ƃ͒��a��30-100nm�̕��召�E�̂ł���A�����ɍL�͈͂̋@�\���^���p�N����mRNA�AmicroRNA(miRNA)���܂݂܂��B�Ɖu�זE���ᇍזE�Ȃǂ̍זE���\���I�ɕ��o���ꑼ�̍זE�֎�荞�܂�邱�Ƃɂ��A�G�N�\�\�[���Ɋ܂܂��@�\���^���p�N����miRNA���`�B����܂��B��X��LMP1�ɂ���ėU�����ꂽ�^���p�N���G�N�\�\�[���Ɏ�荞�܂�A���ꂪ���V�s�G���g�זE�ւƓ`�B����邱�Ƃɂ��Ĕ��\���܂����B����A���Ҍ������̃^���p�N����miRNA���o�C�I�}�[�J�[�ɂȂ肤�邩�������Ă����\��ł��B
�@��ᇂ���芪���������́A��ᇕa�Ԑ����w�ɂ����ďd�v�Ȗ�����S���Ă���A�����ɂ��Ă̌����͌��ݒ��ڂ��W�߂Ă��܂��B��ᇍזE������o���������E��G�N�\�\�[�����o�R���ԐړI�ȍזE�ԑ��ݍ�p���s���Ă��邱�Ƃ��ߔN�̌����ɂ�薾�炩�ɂȂ��Ă��܂��B�G�N�\�\�[���Ƃ͒��a��30-100nm�̕��召�E�̂ł���A�����ɍL�͈͂̋@�\���^���p�N����mRNA�AmicroRNA(miRNA)���܂݂܂��B�Ɖu�זE���ᇍזE�Ȃǂ̍זE���\���I�ɕ��o���ꑼ�̍זE�֎�荞�܂�邱�Ƃɂ��A�G�N�\�\�[���Ɋ܂܂��@�\���^���p�N����miRNA���`�B����܂��B��X��LMP1�ɂ���ėU�����ꂽ�^���p�N���G�N�\�\�[���Ɏ�荞�܂�A���ꂪ���V�s�G���g�זE�ւƓ`�B����邱�Ƃɂ��Ĕ��\���܂����B����A���Ҍ������̃^���p�N����miRNA���o�C�I�}�[�J�[�ɂȂ肤�邩�������Ă����\��ł��B5. ��������ƃI�[�g�t�@�W�[
�@�I�[�g�t�@�W�[�́A�h�{�̊m�ۂ�זE���ɐ������s�Ǖ����̏�����ړI�Ƃ��āA�זE�����̕��������铭���̂��ƂŁA�����⊴���ǁA�_�o�ϐ������A���A�a�ȂǑ���ɂ킽�鎾���ɊW���Ă��܂��B����זE�ɂ����āA�I�[�g�t�@�W�[�͔����ɑ��ė}���I�ȓ��������܂����A�זE����U��������ƁA�I�[�g�t�@�W�[�͊��זE���B�ɕK�v�ȃG�l���M�[�������s������A�זE�������������ƁA���זE�̑��B�E�i�W�Ɋ�^���铭�������Ă��܂��܂��B
�����͉��w�Ö@����ː����ÂɊ��������A�O�ȓI�؏�������ȏꍇ������A���Âɉ��w�Ö@�E���ː��Ö@���I������邱�Ƃ����т��т���܂��B����Ȃ鉻�w�Ö@�̎��Ì��ʌ���̂��߁A��X�͂��̃I�[�g�t�@�W�[�Ɗ��̊W�ɒ��ڂ��܂����B���̌��ʁA�I�[�g�t�@�W�[�}���������R���܂̌��ʂ������A��������זE�̑��B��}���邱�Ƃ��킩��A�I�[�g�t�@�W�[�̒��߂��V���Ȏ��Ð헪�ƂȂ�\������������܂����B
6. ��������̐V�K�o�C�I�}�[�J�[�Ɋւ��錤��
�@������ł͉��w�Ö@�ƕ��ː��Ö@�ɂ��\���ȋǏ������}�邱�Ƃ��d�v�ł��B���u�]�ڂ����̓����Ɗr�ׂč��p�x�Ȃ��߁A���Ăł͉��w���ː��Ö@�ɑ����⏕���w�Ö@���s���̂��W���I�ł��B�������A���w���ː��Ö@�ɑ����ĕ⏕���w�Ö@���{�s���邱�Ƃ͎��ÓŐ��������A���{���܂ރA�W�A�ł͕⏕���w�Ö@�͍s���Ȃ����Ƃ������l�ł��B�����ŁA���w���ː��Ö@���I���������_�Ńo�C�I�}�[�J�[���w�W�Ƃ��āA��ᇎc�����X�N�������Ǘ�ɂ̂ݕ⏕���w�Ö@���{�s�ł���A��ᇎc�����X�N���Ⴂ�Ǘ�̕��S�𑝂₷���ƂȂ��A�Ǐ�����щ��u�]�ڐ���ɂ��\��̌��オ���҂ł���ƍl���Ă��܂��B
�@�قƂ�ǂ̏�������́AEpstein-Barr�E�C���X�iEBV�j�̐��������������v���ł��B���݁A�ł��s�q�o�C�I�}�[�J�[�ł��錌����EBV-DNA�R�s�[����ʖ@�́AEBV-DNA�����זE�ɗR�����邽�ߐ�������������זE�̊�������K���������f���܂���B����Ɍ�����EBV-DNA�R�s�[���͎�ᇑ̐ςƔ�Ⴗ�邽�߁A���Ì�Ɋ�������I�ɏ��������Ǘ�ł͔����Ȋ����c�����Ă��Ă�EBV-DNA�̓���E��ʂ͍���ł��B
�@�ߔN�A��������זE����EBV-encoded small RNAs (EBERs)��ABamHI A rightward transcripts (BART miRNAs)�Ȃǂ�EBV�֘ARNA (EBV-RNA)���זE�O�ɕ��傳��A�����ł����肳��邱�Ƃ����炩�ɂȂ��Ă��܂����B�����ŁA�������́A���Ì�̊��זE�c���̗L���肷��ɂ́A��ᇑ̐ςƔ�Ⴗ��EBV-DNA�����A��ᇑ̐ςɂ�炸���������זE���犈���I�ɎY���E���傳���EBV-RNA�������o�C�I�}�[�J�[�Ƃ�������D��Ă���ƍl���A���̗l��EBV-RNA�ɂ��Ċ�b�������ł��B
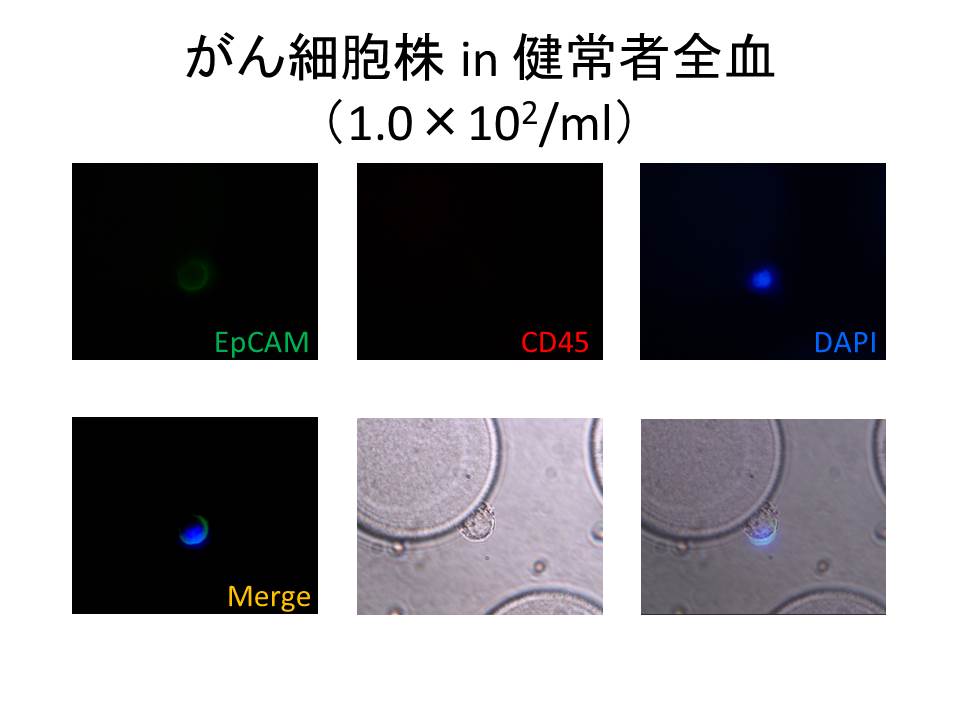
���̈���ŁA�ߔN����ȃV���R���`�b�v��p���āA�����z����זE�����o����V�X�e��������Ă���A���̃V�X�e������������̃o�C�I�}�[�J�[�ƂȂ肦�Ȃ����������ł��B���̃V���R���`�b�v�����ǂ��āAEpCAM��W���Ƃ����V�X�e���ɉ����AEGFR��W���Ƃ����V�X�e�����\�z���A���x�̌����ڎw���A��������𒆐S�ɍL�������ʼn�͂��s���Ă��܂��B
 |
 |
|
| �iCTC chip�j |
���������ɂ������`�q�ψ�
�@Activation-induced deaminase�@(AID)��APOBEC3�́A��`�q�ɕψق�U������y�f�ł���A�q�g�̓������Ɖu�ɐ[���֗^���Ă��܂��B�����̃T�u�t�@�~���[�ɒ��ڂ��āA���݁A�����ɂ����锭���̒��x����͂���ƂƂ��ɁA���ۂɋ@�\�I�Ɉ�`�q�ψق��N�����Ă���̂��A����w���q��`�w�@�������������Ƃ̋����������s���Ă��܂��B����܂ŁA�q�g������E�B���X�ƒ��������ɒ��ڂ��Č�����i�߂Ă��܂����B���̌��ʁAAPOBEC3�́A�ʏ�̓E�B���X�r���̕����ɓ����܂����A�����I�ɃE�B���X��`�q�ɕψق�����Ƌt�ɔ������������Ă��܂��������܂����B����ɁA��������ɂ��Ă����݉�͒��ŁA��ᇃE�B���X�ɂ���Ă��̐�������x�ɍ��ق��Ȃ����������ł��B�܂��A�����̓������Ɖu��U������O�I�h�����q�ɂ��Ă��������ł��B
�V�K�J���R���܂̗Տ����p�Ɍ���������
 �@�V�X�v���`���͓����ɑ���R�����Âɂ�����L�[�h���b�O�̈�ł��i���}�j�B�������A���̕���p�Ƃ��Đt�@�\��Q������t�@�\�̒ቺ�������҂���ɂ͎g�p�ł��܂���B�܂��A���ɓ]�ځE�Z�������ꍇ��V�X�v���`���ɑϐ������Ĕ������ꍇ�ɂ͌��ʂ����サ�Ă��܂��Ƃ������_������܂��B�����ŁA���̖��_���N���A���ׂ��]���̃V�X�v���`�������ǂ���������̐V�K�R���܂��J������Ă��Ă��܂��B
�@�V�X�v���`���͓����ɑ���R�����Âɂ�����L�[�h���b�O�̈�ł��i���}�j�B�������A���̕���p�Ƃ��Đt�@�\��Q������t�@�\�̒ቺ�������҂���ɂ͎g�p�ł��܂���B�܂��A���ɓ]�ځE�Z�������ꍇ��V�X�v���`���ɑϐ������Ĕ������ꍇ�ɂ͌��ʂ����サ�Ă��܂��Ƃ������_������܂��B�����ŁA���̖��_���N���A���ׂ��]���̃V�X�v���`�������ǂ���������̐V�K�R���܂��J������Ă��Ă��܂��B
 �@NC-6004�͓�����w�H�w���ɂĊJ�����ꂽ�~�Z�����V�X�v���`���ł��B�V�X�v���`���������q�~�Z���ɓ����i�E�}�j���ƂŎ�ᇑg�D�ɑI��I�ɏW�ς��A�R��ᇌ��ʂ����߂����A�t�@�\��Q�Ȃǂ̗L�Q���ۂ��y�����������Ƃɐ������܂����B�������ł�in vivo�i�t���X�R���̍זE�����j��in vitro�i�}�E�X�����j�ɂĂ���������܂����B����NC-6004�͍����O�ɂđ�T���������i�s���ł���A��U���A��V���������o�Ă̗Տ����p�����҂���Ă��܂��B�@
�@NC-6004�͓�����w�H�w���ɂĊJ�����ꂽ�~�Z�����V�X�v���`���ł��B�V�X�v���`���������q�~�Z���ɓ����i�E�}�j���ƂŎ�ᇑg�D�ɑI��I�ɏW�ς��A�R��ᇌ��ʂ����߂����A�t�@�\��Q�Ȃǂ̗L�Q���ۂ��y�����������Ƃɐ������܂����B�������ł�in vivo�i�t���X�R���̍זE�����j��in vitro�i�}�E�X�����j�ɂĂ���������܂����B����NC-6004�͍����O�ɂđ�T���������i�s���ł���A��U���A��V���������o�Ă̗Տ����p�����҂���Ă��܂��B�@
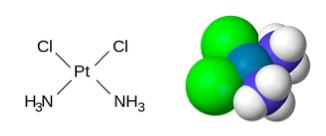
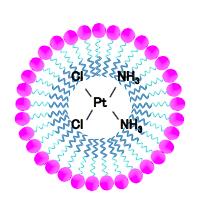
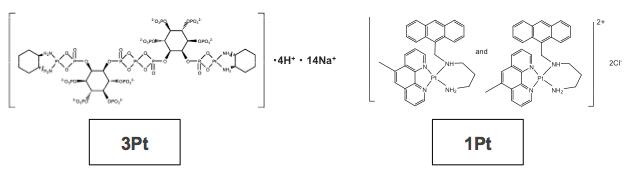
�A1Pt�E3Pt�͋����w��w���ɂĊJ�����ꂽ�d�^�V�X�v���`���ł��B1Pt�i�J�`�I���^�V�X�v���`���j�̓V�X�v���`���ɖF�����A�~������������i���}�j���ƂŃJ�`�I�����i�z�C�I�����j�������̂ł��B����ɂ��V�X�v���`��������R��ᇌ��ʂƑϐ��̃N���A�A�t�@�\��Q�Ȃǂ̗L�Q���ۂ̌y�������҂���܂��B����3Pt�i�A�j�I���^�V�X�v���`���j�̓V�X�v���`���Ƀ����_�����������i���}�j���ƂŃA�j�I�����i�A�C�I�����j���A���ɏW�ς�������������������̂ł��B����ɂ�荜�ɓ]�ځE�Z���������ɑ��Č��ʂ����҂����܂��B����1Pt�E3Pt�͓������ɂ�in vitro�Ain vivo�������i�s���ł��B
 |
||
Patient-derived xenograft�𗘗p�����ʉ���Â̌���
 |
||
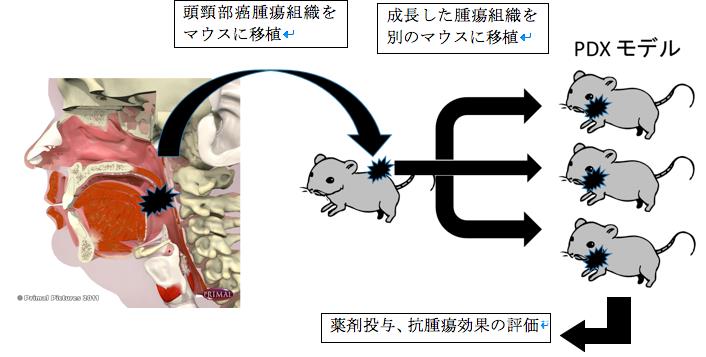
�@�����͌������ʂɂ���Ď�ᇓ������傫���قȂ�A�܂����w�Ö@�ɑ��銴�����l�ł��B�]���A�q�g�����i���o�A�������j����������ꂽ�זE����p�����������L���s���Ă��܂������A��`�I�w�i��ˑR�ψق̎�ނ��זE�����ƂňقȂ邽�ߎ��ۂ̓������\���郂�f���Ƃ��Ă͕s���S�ł����B
�@�َ�̍זE�ɑ��鋑�┽����S���N�����Ȃ����Ɖu�s�S�}�E�X�Ƀq�g���g�D���ڐA�����ipatient-derived xenograft�FPDX���f���j�́A�q�g����g�D�𒉎��ɍČ����邱�Ƃ��m���Ă���A�X�̊��҂̂���g�D�������������x���ōČ����郂�f���Ƃ��āA���E�ŊJ�����i�߂��Ă��܂��B�������ł�PDX���f���}�E�X���쐬���A�p���邱�Ƃł��Տ��f������ܕ]����ڎw���������s���Ă��܂��BPDX���f���}�E�X�����Җ{�l�ɂ���鏬���Ȋ����҂Ƃ��Ċ��p���邱�Ƃʼn��w�Ö@�̕]�����\�ƂȂ�Δ��ɓ��F�̂��錤���ɂȂ�܂��B�܂��{�����͍��㑽�l�����铪�����Âɂ����Ċ��҂��ƂɍœK�Ȏ��Ö@��I���A���Ȃ킿�u�ʉ���Áv�ւ̓W�J���p�����҂ł��܂��B
�@�َ�̍זE�ɑ��鋑�┽����S���N�����Ȃ����Ɖu�s�S�}�E�X�Ƀq�g���g�D���ڐA�����ipatient-derived xenograft�FPDX���f���j�́A�q�g����g�D�𒉎��ɍČ����邱�Ƃ��m���Ă���A�X�̊��҂̂���g�D�������������x���ōČ����郂�f���Ƃ��āA���E�ŊJ�����i�߂��Ă��܂��B�������ł�PDX���f���}�E�X���쐬���A�p���邱�Ƃł��Տ��f������ܕ]����ڎw���������s���Ă��܂��BPDX���f���}�E�X�����Җ{�l�ɂ���鏬���Ȋ����҂Ƃ��Ċ��p���邱�Ƃʼn��w�Ö@�̕]�����\�ƂȂ�Δ��ɓ��F�̂��錤���ɂȂ�܂��B�܂��{�����͍��㑽�l�����铪�����Âɂ����Ċ��҂��ƂɍœK�Ȏ��Ö@��I���A���Ȃ킿�u�ʉ���Áv�ւ̓W�J���p�����҂ł��܂��B
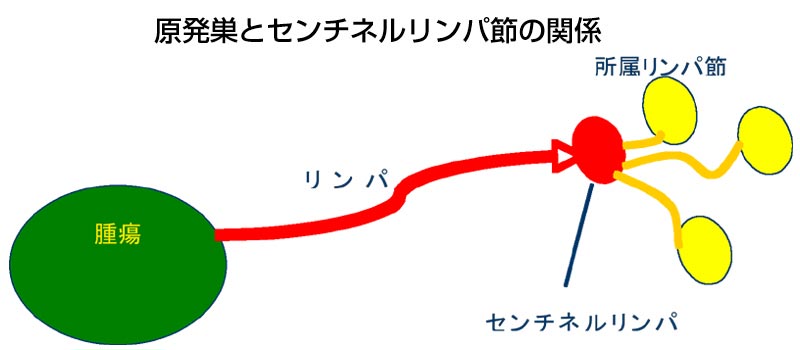
�����ɂ�����Z���`�l�������p�ߐ����̈Ӌ`
�@�]���A���̊O�ȓI���Âł͎�ᇂƃ����p�ߓ]�ڂ̉\���̂��镔����؏����邱�Ƃ��W���I�Ȏ��ÂƂ���Ă��܂����B����͓��z�����ł͎�ւ̃����p�ߓ]�ځi�����p�ߓ]�ځj���N�����Ǝ��Ð��т������Ȃ邱�Ƃ��m���Ă��邽�߂ł��B�z�������p�߂ɂ������p�O�̊��̓]�ڂ̗L���́A����܂�CT, MRI, �����g�����Ȃǂɂ�胊���p�߂̑傫����`�ȂǂɊ�Â��čs���Ă��܂����B�����������̌������s�����Ƃ��Ă��A�K���������m�Ɋ��̃����p�ߓ]�ڂ̗L����f�f���邱�Ƃ͂ł��܂���B�Ⴆ�ΐ���ł͊��̑傫����2�`4cm�قǂ̏ꍇ�ł�30���ɐ��ݓI�Ɍz�������p�ߓ]�ڂ���Ƃ���Ă��܂��B���̏ꍇ�A�\�h�I�Ɍz�������p�ߓE�o�i�z�������p�ߊs���p�j���s����70���̊��҂���ł͕s�v�Ȏ�p�ɂȂ��Ă��܂��܂��B�Z���`�l�������p�߂Ƃ́A���i�������j����ŏ��ɓ]�ڂ�������Ƃ���郊���p�߂̂��Ƃ��w���܂��i���}�j�B��p�O�ɓ���Ȗ�܂����̎��͂ɒ��˂��A�Z���`�l�������p�߂肵�܂��B��p�̍ۂɁA���̃����p�߂�E�o�����̓]�ڂ��Ȃ�����̎��ӂ̃����p�߂ɂ����̓]�ڂ��Ȃ��Ƃ݂Ȃ��܂��B���̃Z���`�l�������p�߂̗��_�͂��łɓ����∫�����F��Ȃǂł͍L���Տ��ōs���Ă��܂��B�����ł��ߔN���̗L�p��������Ă��Ă���A���Ȃł��Ώۂ̊��҂���̓��ӂ���Ŏ��Â��s���Ă��܂��B�����A�����ł��Z���`�l�������p�ߐ������W�����Âɑg�ݍ��܂��A�X�̊��҂���ɂ��������ÁA���Ȃ킿�z�������p�ߓ]�ڂ̂��銳�҂���̂z�������p�ߊs���p���s�����Ƃ��ł��܂��B